Jian-zhi WANG2,4, Ze-fen WANG2,3
2Pathophysiology Department, Key Laboratory of Neurological Diseases of Hubei Province, Tongji Medical School, Huazhong University of
Science and Technology, Wuhan 430030, China; 3Department of Physiology, Medical College, Wuhan University, Wuhan 430071, China
KYSYMYKSENI on : Esiintyykö normaalissa APP-holoproteiinierityksessä jotain diurnaalisuutta, vuorokausirytmiä? Tässä sitten selviää, että varsinainen melatoniini, pimeähormoni, erittyy käpylisäkkeestä (Pineal body) iän mukana huonommin ja erityisen huonosti AD-taudissa, jossa sen osuus ikäänkuin säätelystä jää puuttumaan.
Jos säätely toimii ja pimeähormonia erittyy, APP mRNA säätyy alemmaksi ja APP muodostus alenee ja hyvät ja huonot tuotteet alenevat määrältään. Tämä artikkeli kertoo tästä. En suomenna vielä, mutta otan talteen. Melatoniini on antioksidantti ja neuroninsuojatekijä. Jos holoproteiinin APP-eritys on normaalia, siitä muodostuva liukoinen allfa sAPP on myös neuronin suojatekijä, nopeasti häviävä sen jälkeen, kun erittyy. Tässä pohditaan onko melatoniinilla joitain terapeuttisia mahdollisuuksia AD taudissa tai sen estossa.
Abstract
Alzheimer disease (AD), an age-related neurodegenerative disorder with progressive
loss of memory and deterioration of comprehensive cognition, is characterized
by extracellular senile plaques of aggregated β-amyloid (Aβ), and intracellular
neurofibrillary tangles that contain hyperphosphorylated tau protein.
Recent studies (2006) showed that melatonin, an indoleamine secreted by the pineal gland, may play an important role in aging and AD as an antioxidant and neuroprotector.
Melatonin decreases during aging and patients with AD have a more profound
reduction in this hormone. Data from clinical trials indicate that melatonin supplementation
improves sleep, ameliorates sundowning, and slows down the progression
of cognitive impairment in Alzheimer’s patients.
Melatonin efficiently protects neuronal cells from Aβ-mediated toxicity via antioxidant and anti-amyloid properties: it not only inhibits Aβ generation, but also arrests the formation of
amyloid fibrils by a structure-dependent interaction with Aβ.
Our recent studies have demonstrated that melatonin efficiently attenuates Alzheimer-like tau hyperphosphorylation. Although the exact mechanism is still not fully understood, a direct regulatory influence of melatonin on the activities of protein kinases and
protein phosphatases is proposed.
Additionally, melatonin also plays a role in
protecting cholinergic neurons and in anti-inflammation.
Here, the neuroprotective
effects of melatonin and the underlying mechanisms by which it exerts its effects
are reviewed. The capacity of melatonin to prevent or ameliorate tau and Aβ
pathology further enhances its potential in the prevention or treatment of AD.
- Introduction
metabolite, is synthesized mainly by the pineal gland. Melatonin
has a number of physiological functions, including
regulating circadian rhythms, clearing free radicals, improving
immunity, and generally inhibiting the oxidation of
biomolecules. It is generally accepted that melatonin deficit
is closely related to aging and age-related diseases[1]. Decreased
levels of melatonin in serum and in cerebrospinal
fluid (CSF) and the loss of melatonin diurnal rhythm are observed
in patients with Alzheimer disease (AD)[2−6].
Interestingly, the level of melatonin in CSF decreases with
the progression of AD neuropathology as determined by
the Braak stages[6]. Melatonin levels both in CSF and in
postmortem human pineal gland are already reduced in preclinical
AD subjects, who are cognitively still intact and have
only the earliest signs of AD neuropathology[2,6]. A strong
correlation exists between pineal content and CSF level of
melatonin[2] and between CSF and plasma melatonin levels[7],
suggesting that a reduced CSF melatonin level may serve as
an early marker for the very first stages of AD. Although the
pineal gland of AD patients has molecular changes, no
changes in pineal weight, calcification or total protein content
have been observed[2,8]. A recent study showed that β1-
adrenergic receptor mRNA disappeared, and MAOA
activity and gene expression were upregulated in AD patients,
suggesting that the dysregulation of noradrenergic innervations
and the depletion of serotonin, the precursor of
melatonin, might be responsible for the loss of melatonin
rhythm and reduced melatonin levels in AD[2]. In AD patients,
melatonin supplementation has been suggested to improve
circadian rhythmicity, for example decreasing agitated
behavior, confusion and “sundowning”, and to produce
beneficial effects on memory in AD[9–13]. Therefore, melatonin
supplementation may be one of the possible strategies
for symptomatic treatment. Moreover, melatonin treatment
seems to be safe because of its marked low toxicity[14,15].
However, adverse drug reactions may occur, such as (i) fever
on the first day of melatonin treatment, which is possibly
a reaction to the thermoregulatory function of melatonin; (ii)
hyperkinesia or complaints of restless legs; (iii) menorrhagia,
which may be explained by a decrease in plasma folliclestimulating
hormone (FSH) and luteinizing hormone (LH);
(iv) pigmentation on arms and legs; (v) headache and abdominal
reactions, such as nausea, dyspepsia and abdominal
pain; (vi) thrombosis; and (vii) drowsiness[16,17]. When a
pharmacological dose of melatonin (3.0 mg) is administered
to elderly people, it not only induces sleep but also induces
hypothermia. Moreover, intravenous administration of melatonin
to schizophrenic patients in remission causes a worsening
of psychotic symptoms, which persists even after the
treatment is interrupted[18]. Pregnant women should avoid
melatonin, because its (functional) teratological effects are
not known. Additionally, there are also concerns with regard
to the potential vasoactive nature of melatonin.
There are two characteristic pathologies in the brains of
patients with AD: neurofibrillary tangles (NFT) composed of
hyperphosphorylated microtubule-associated protein tau,
and senile plaques (SP) mainly composed of Aβ peptide,
derivations from the proteolytic processing of amyloid precursor
protein (APP)[19]. Convincing evidence indicates that
Aβ can mediate neurotoxicity through a complex series of
interactions that involves increasing free radicals, raising
intracellular calcium concentrations, and even triggering
apoptosis[20]. Aβ is generally believed to play a major role in
promoting neuronal degeneration by rendering neurons more
vulnerable to age-related increases in levels of oxidative stress
and impairments in cellular energy metabolism[21]. Tau protein
is a major microtubule-associated protein that promotes
microtubule assembly and stabilizes microtubules; it also
takes part in the formation and maintenance of the axonal
structure[22]. Hyperphosphorylated tau reduces the ability
to stabilize microtubules, leading to disruption of the
cytoskeletal arrangement and neuronal transport[23,24]. The
extent of neurofibrillary pathology, and particularly the number
of cortical NFT, correlates positively with the severity of
dementia[25]. Although the exact pathogenesis of AD is not
fully understood, both Aβ deposition and tau hyperphosphorylation
play critical roles in the development of AD.
Because melatonin is able to improve some of the clinical
symptoms of AD, and because melatonin levels decrease
dramatically during AD, studies on the relationship between
melatonin and tau/Aβ pathology will be helpful to understand
and to assess its potential in the prevention or treatment
of AD. This review will address the protective effects
of melatonin on the pathological development of AD. Most
of the data presented here are from animal studies, because
the efficacy of melatonin in preclinical AD is currently not
well documented.
Role of melatonin in tau hyperphosphorylation
Effect of melatonin on cytoskeletal reorganization The
cytoskeleton plays a key role in maintaining the highly asymmetrical
shape and structural polarity of neurons that are
essential for neuronal physiology, and cytoskeletal reorganization
plays a key role in neurogenesis. In neurodegenerative
diseases, the cytoskeleton is abnormally assembled, and
impairment of neurotransmission occurs[26,27]. Current data
indicate that melatonin promotes neurogenesis through
cytoskeletal rearrangements in a receptor-dependent and
possibly subtype-selective manner[24,25]. Melatonin receptor
1 (MT1) is thought to be responsible for melatonininduced
neurite formation[28,29]. In addition, to promote
microtubule rearrangement through Ca2+/calmodulin antagonism[
30], melatonin could modulate phosphorylation and organization
of vimentin intermediate filaments via protein kinase
C activation in N1E-115 cells[31,32]. Alterations in cytoskeletal
organization and melatonin levels in aging and
neurodegenerative diseases support the notion that cytoskeletal
disruption is presumably associated with melatonin
deficiency. These observations prompted us to investigate
whether melatonin has beneficial effects on tau hyperphosphorylation,
one of the characteristic pathological features
in the AD brain.
Inhibition of tau hyperphosphorylation by melatonin
Cytoskeletal alterations in AD are predominantly characterized
by intracellular NFT mainly composed of an abnormal
hyperphosphorylated form of the microtubule-associated
protein, tau[33]. In healthy neurons, tau binds and stabilizes
microtubules, which make up the cytoskeleton of the cell, by
a reversible enzymatically mediated phosphorylation and
dephosphorylation process. Hyperphosphorylation of tau
leads to a decreased affinity with microtubules and the disruption
of the neuronal cytoskeleton, as well as resulting in
resistance to proteolytic degradation and gradual accumulation
in the cell body[34].
The phosphorylation of tau is strictly regulated by a panel
of protein phosphatases and protein kinases[35]. Inhibition
of tau hyperphosphorylation is one target in AD treatment.
Recently, we systemically studied the effect of melatonin on
tau hyperphosphorylation induced by a series of activators
of protein kinases and inhibitors of protein phosphatases.
We found that melatonin efficiently attenuates tau or
neurofilament hyperphosphorylation induced by wortmannin[36],
calyculin A[37,38] and okadaic acid[39] in N2a and SH-SY5Y
neuroblastoma cells. Our in vivo studies further demonstrated
that melatonin significantly ameliorated tau hyperphosphorylation
elicited by wortmannin[40] and isoproterenol[
41,42] in rats. To elucidate the mechanisms underlying the
inhibitory effect of melatonin on tau hyperphos-phorylation,
alterations of the activities of protein kinases and phosphatases
were detected. Melatonin treatment not only inhibited
wortmannin-induced glycogen synthase kinase-3
(GSK-3) activation, isoproterenol-induced protein kinase A
(PKA) activation, and calyculin A-induced protein phosphatase-
2A (PP-2A) inactivation, but also antagonized the
oxidative stress induced by these agents [34,35,40]. These results
from our studies provide supportive evidence for the strong
efficacy of melatonin supplementation in inhibiting tau
hyperphosphorylation induced by other stimuli. The next
question is whether a decrease in melatonin levels would
alter the phosphorylation state of the tau protein. To answer
this question, we inhibited melatonin biosynthesis by injecting
haloperidol, an inhibitor of 5-hydroxyindole-Omethyltransferase
(one of the key enzymes in melatonin
synthesis), into the lateral ventricle and the peritoneal cavity
in rats[43]. The decreased serum level of melatonin, as
detected by fluorescence high-performance liquid chromatography,
confirmed the successful inhibition of melatonin biosynthesis
by haloperidol. More importantly, we found that
inhibition of melatonin biosynthesis not only resulted in
spatial memory impairment in rats, but also induced a reduction
in tau phosphorylation with a concomitant decrease in
PP-2A activity. Supplementation with melatonin by prior
injection for 1 week and reinforcement during the haloperidol
administration period significantly improved memory retention
deficits, arrested tau hyperphosphory-lation and
oxidative stress, and restored PP-2A activity[43]. As far as we
know, this is the first report providing direct evidence for the
physiological regulation by melatonin of tau phosphorylation,
and PP-2A activity, as well as spatial memory. This finding
is of great interest and significance because of the profoundly
decreased melatonin levels and reduction in PP-2A activity
in AD brain[44]. Although it is unclear whether diminished
melatonin concentration is one of the causative factors or
only a secondary process in AD pathology is unclear, our
results strongly implicate decreased melatonin in Alzheimerlike
spatial memory impairment and tau hyperphosphorylation,
as well as reduced PP-2A activity. Melatonin may play
an important role in maintaining the physiological activity of
PP-2A through a currently unknown mechanism, and decreased
melatonin may be critical in the development of neurofibrillary
degeneration. As haloperidol not only inhibits 5-
hydroxyindole-O-methyltransferase, but also antagonizes
dopamine D2 receptors, it is important to explore more selective
means to suppress melatonin levels in the brains of
experimental animals.
Possible mechanisms underlying the effect of melatonin
on tau hyperphosphorylation Chemical agents used in
our studies, including wortmannin, isoproterenol and
calyculin A, not only induced tau phosphorylation, but also
initiated oxidative stress, as manifested by an elevated level
of malondialdehyde and an altered activity of superoxide
dismutase[36,37,39]. Furthermore, melatonin is a potent direct
free radical scavenger and indirect antioxidant that acts by
augmenting the activity of several important antioxidative
enzymes, for example superoxide dismutase, glutathione peroxidase
and glutathione reductase[45]. Oxidative stress is
known to influence the phosphorylation state of tau[46−48]. In
a more recent study we have also demonstrated that calyculin
A, a selective inhibitor of protein phosphatase of PP-2A and
PP-1 that has little or no direct effect on other phosphatases
or kinases, induced a significant activation of GSK-3 via oxidative
stress[35]. It is therefore possible that prevention
against tau phosphorylation by melatonin is partially due to
antioxidant activity.
However, more importantly, although the precise underlying
mechanisms are not fully understood, melatonin may
act as an enzyme modulator in a way that is unrelated to its
antioxidant properties. Accumulating data provide evidence
for the regulation by melatonin of protein kinases including
PKA[49,50], protein kinase C (PKC)[29,51], Ca2+/calmodulindependent
kinase II(CaMKII)[52], and the mitogen-activated
protein kinase (MAPK) family[53]. The documented correlation
between melatonin and cAMP indicates that melatonin
might inhibit PKA activity through the melatonin receptorcoupled
inhibition of adenylyl cyclase and reduction of
cAMP[49,50]. Although there is no evidence of a direct relationship
between melatonin and GSK-3 activity, a recent
study has found that melatonin treatment leads to elevated
phosphorylation of Akt[54], an upstream regulator of GSK-3.
It is possible that melatonin might at least partially inhibit
GSK-3 activity through activating the phosphatidyl inositol-
3 kinase (PI-3K)/Akt signaling pathway. Considering the
regulation of GSK-3 activity by other protein kinases, we
cannot exclude the possible contribution of melatonin-induced
activation of the PKC and MAPK families. Based on
our own studies and those by other groups, we believe that
melatonin may function as an upstream modulator of extensive
protein kinases and protein phosphatases, and GSK-3
is one of the most implicated as targets (Figure 1). Further
study is necessary to fully elucidate the signal transduction
modulated by melatonin.
- Melatonin and Aβ toxicity
- Aβ is composed of 39−43 amino acid residues derived from proteolytic
role in the dysfunction and death of neurons in AD[19,21].
- Mature APP is processed proteolytically by distinct
α-pathway involves the cleavage of APP within the
Aβ sequence by α-secretase to release an N-terminal APP
fragment, which in turn is cleaved by γ-secretase. Thus, the
cleavage by γ-secretase precludes the formation of Aβ.
- The amyloidogenic β-secretase pathway, which results in the
cleavage of β-secretase and γ-secretases at the N- and Cterminals
of the Aβ sequence, respectively[64].
- Melatonin has been found to have regulatory effects on APP metabolism.
of secretion of soluble APP (sAPP) in different cell lines
by interfering with APP full maturation[56]. Melatonin also
affected the mRNA level of APP in a cell type-specific manner.
Pretreatment with melatonin resulted in a significant reduction
in the APP mRNA level in PC12 cells, but failed to produce
this effect in human neuroblastoma cells[57]. We have
also demonstrated that melatonin reduces Aβ generation in
mouse neuroblastoma N2a cells harboring APP695
[58]. An in vivo study showed that melatonin did not affect the expression
of APP holoprotein in transgenic Tg2576 mice[59]
Additionally, administration of melatonin efficiently reduced Aβ
generation and deposition in vivo[59,60] and in vitro[56–58,61].
However, a recent study showed that, despite achieving high
plasma concentrations of melatonin, chronic melatonin
therapy in old Tg2576 mice initiated at 14 months of age not
only failed to remove existing plaques, but also failed to
prevent additional Aβ deposition. This result is in contrast
with those of diminished Aβ in melatonin-treated wild type
mice[60] and reduced Aβ and protein nitration in melatonintreated
Tg2576 mice[59]. The age at initiation of melatonin
treatment may be the key difference that accounts for the
discrepancy between the studies of Matsubara et al[59] and
Quinn et al[62], in which the same transgenic Tg2576 mouse
model was used. Amyloid plaque pathology typically appears
in Tg2576 mice at 10–12 months of age[63]. Melatonin
treatment in the study of Matsubara et al was started at 4
months of age (prior to the appearance of hippocampal and
cortical plaques)[59], an earlier pathological stage compared
with 14 months of age in the study of Quinn et al[62]. However,
both studies concur in finding little evidence of the potent
antioxidant effects of melatonin in the oldest mice. These
findings indicate that melatonin has the ability to regulate
APP metabolism and prevent Aβ pathology, but fails to exert
anti-amyloid or antioxidant effects when initiated after the
age of Aβ deposition.
Although consistent conclusions were achieved, none
of the related studies further explain how melatonin exerts its
inhibitory effect on Aβ generation.
- The proteolytic cleavage of APP by the α-secretase pathway is regulated by many
the PKC-dependent mechanism is one of the most recognized.
Stimuli such as muscarinic and metabotrophic glutamate receptor agonists
and phorbol esters share the capacity to stimulate soluble
APP secretion and inhibit Aβ formation through PKC activation[
64]. The mechanism whereby PKC activity increases
soluble APP secretion is still unknown, but it may involve
additional kinase steps and the eventual activation of the
secretases that mediated APP cleavage. Recently, the inhibitory
regulation by GSK-3 on Aβ generation has been
well established[65–67]. GSK-3 interacts with presenilin-1, a
cofactor for γ-secretase, implying that GSK-3 may function as
a component in the γ-secretase complex[68,69]. Assuming that
melatonin can influence PKC and GSK-3 activity as mentioned
earlier, it is postulated that melatonin may regulate
APP processing through the PKC and GSK-3 pathways.
Because PKC is an upstream regulator of GSK-3, GSK-3 may
be one of the common signal pathways that regulate both
Aβ generation and tau hyperphosphorylation (Figure 1).
- Regulation by melatonin of the formation of Aβ fibrils
and resistance to proteolytic degradation, depend on the
ability of peptides to form β-sheet structures and/or amyloid
fibrils[70,71]. Intervention in the Aβ aggregation process can
be considered an approach to stopping or slowing the progression
of AD. Melatonin can interact with Aβ40 and Aβ42
and inhibit the progressive formation of β-sheet and/or amyloid
fibrils[72–74]. The antifibrillogenic effect of melatonin has
been demonstrated by different techniques, including circular
dichroism (CD) spectroscopy, electron microscopy and
nuclear magnetic resonance (NMR) spectroscopy, and
memory deficits, as well as cholinergic system dysfunction,
as indicated by a profound reduction in ChAT activity in the
frontal cortex and hippocampus. Long-term melatonin treatment
(4 months) significantly ameliorated such neuropathological,
behavioral and biochemical changes in APP695
transgenic mice[80]. Another study by Feng by et al also
showed that similar treatment with melatonin antagonized
spatial memory impairment and decreased ChAT activity in
ovariectomized adult rats[85]. Additionally, an inhibitory effect
of melatonin on ACh release was found in intact rabbit
retinas[86]. These findings indicate that protection of the
cholinergic system may occur at multiple steps that are critical
for ACh synthesis and release (Figure 2).
- Anti-inflammatory actions
shown that non-steroidal anti-inflammatory drug (NSAID)
use decreases the incidence of AD[87]. Aβ itself has been
shown to act as a proinflammatory agent that causes the
activation of many inflammatory components, and SP coexist
with cytokines and chemokines, and are surrounded by
microglia and astrocytes, indicating the involvement of inflammation
in the pathogenesis of AD[88]. The activated microglia
induced by Aβ are the major sources of inflammatory
response. Microglial activation might involve beta-amyloid
binding and the activation of cell surface immune and adhesion
molecules[89]. It has been reported that melatonin attenuates
kainic acid-induced microglial and astroglial responses
as determined by immunohistochemical detection
of isolectin-B4 and glial fibrillary acidic protein (GFAP), the
specific markers for microglia and astroglia, respectively[90].
Oral melatonin administration also attenuated Aβ-induced
proinflammatory cytokines in rat brain[82]. A recent study
showed the potent suppressive effect of melatonin pretreatment
on the ischemia-reperfusion-stimulated ipsilateral increase
in the immunoreactivity for neuronal NO synthase
(nNOS), cyclooxyrenase-2 (COX-2) or myeloperoxidase
(MPO), but not for GFAP, suggesting the contribution of
anti-inflammatory response in neuroprotection against ischemia-
reperfusion damage[91]. Nuclear factor-kappaB (NF-
κB) plays an important role in inflammatory mediator-mediated
signal transduction. Melatonin has been shown to inhibit
tumor necrosis factor (TNF) and brain injury-induced
NF-κB activation[92,93]. These results suggest that the antiinflammatory
properties of melatonin are due to inhibition of
the production of inflammatory mediators and downstream
signal transduction.
- Expectations
based on the fact that the level of melatonin reduces during
aging and in AD patients, as well as for its antioxidant and
anti-amyloid effects. Recent studies from APP transgenic
mice have indicated that early, long-term melatonin supplementation
produces anti-amyloid and antioxidant effects, but
no such effect is produced when melatonin treatment is initiated
after the age of amyloid formation[58–61]. Extensive
clinical trials and studies with transgenic models are necessary
to confirm the role of melatonin at the late pathological
stage of AD. If melatonin has no effect at the late stage of
AD, studies on melatonin should be limited to the prevention
of AD, rather than treatment. Our studies have demonstrated
the efficacy of melatonin in the inhibition of tau
hyperphos-phorylation. As mentioned earlier, GSK-3 may
be one of the common signaling pathways that regulates
both Aβ generation and tau phosphorylation. Moreover,
GSK-3 is considered to be a key protein kinase involved in
Aβ-induced tau hyperphosphorylation. Therefore, the regulation
by melatonin of protein kinases, especially GSK-3, is
worthy of further exploration. Although GSK-3 has been
implicated as a central player in the altered metabolism of
both tau and Aβ, mechanistic links between melatonin and
GSK-3 have so far been only indirectly evidenced by the
sole fact that phosphorylation of a GSK-3 regulator, Akt, in
the brain is augmented by treatment with melatonin. Future
research strategies will need to overcome the current limitations
on insights into the direct functional coupling between
melatonin and GSK-3. For instance, experimental paradigms
such as the one provided by a recent study using a mouse
model of tauopathy[94] could be applied to examination of the
hypothesis of melatonin- and GSK-3-mediated neurodegenerative
tau pathogenesis. In mammals melatonin exerts some
of its functions through two specific high-affinity membrane
receptors belonging to the superfamily of G-protein-coupled
receptors: MT1 and MT2. Decreased MT2 immunore
activity and increased MT1 immunoreactivity have been
reported in the hippocampus of AD patients[95,96]. The connection
between changes in receptor expression and the unsatisfactory
therapeutic effects of melatonin when started at
a late pathological stage of AD remain to be elucidated.
- As a conclusion,
effect, melatonin prevents cells from Aβ-mediated
toxicity not only by inhibiting Aβ generation but also by
inhibiting Aβ aggregation and formation of amyloid fibrils.
Furthermore, melatonin attenuates tau hyperphosphorylation
induced by activation of protein kinases or inhibition of protein
phosphatases. Moreover, melatonin may be involved
in the physilogical regulation of tau phosphorylation. Early,
long-term application of melatonin may at least slow down
the development of AD.

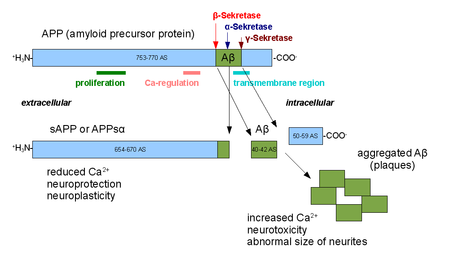
 Tässä on aika valaiseva kuva APP molekyylistä ja niistä kohdista missä alfa-sekretaasin ja betasekretaasin puremat näkyvät sekä gamma-sekretaasin puremakohta.
Tässä on aika valaiseva kuva APP molekyylistä ja niistä kohdista missä alfa-sekretaasin ja betasekretaasin puremat näkyvät sekä gamma-sekretaasin puremakohta.