ä jaksosta joka Abeetalla olisi. Täten tällä ehättävällä alfasekretasilla tapahtuu nonamylogeeninen APP-pilkkoutuminen.
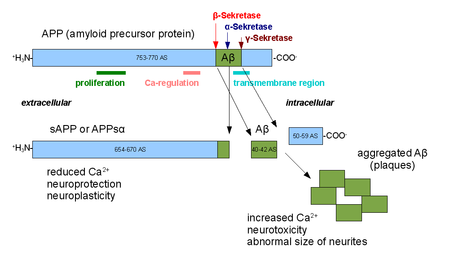
ALFASEKRETAASI on ADAM perheen proteiini, disintegriini ja metalloproteaasi- domaanin omaava entsyymi. jota esiintyy solujen pinnalla ankuuroituneena solukalvoon. Kun APP-molekyyli on ilemstynyt solukalvoon niin alfasekretaasi pilkkoo siitä ulos olevan osan, jonka nimi on APPs alfa, liukoinen alfaAPP ja sitä erittyy solun ulkopuolelle. Tämä on normaalia.
Wikipedia teksti alfasekretaasista.
Alpha secretases are a family of proteolytic enzymes that cleave amyloid precursor protein (APP) in its transmembrane region. Specifically, alpha secretases cleave within the fragment that gives rise to the Alzheimer's disease-associated peptide amyloid beta when APP is instead processed by beta secretase and gamma secretase. Thus, alpha-secretase cleavage precludes amyloid beta formation and is considered to be part of the non-amyloidogenic pathway in APP processing. Alpha secretases are members of the ADAM ('a disintegrin and metalloprotease domain') family, which are expressed on the surfaces of cells and anchored in the cell membrane. Several such proteins, notably ADAM10, have been identified as possessing alpha-secretase activity. Upon cleavage by alpha secretases, APP releases its extracellular domain - a fragment known as APPsα - into the extracellular environment in a process known as ectodomain shedding.[1]
ADAM10 consists of two protein domains, a disintegrin domain and a prodomain; however, only the prodomain is required for APP processing.
Other ADAM proteins, ADAM17 (also called TACE, tumor necrosis factor-α converting enzyme),
have also been identified as alpha secretases; extracellular expression of mutant ADAM9 (also known as MDC9 or meltrin gamma) lacking the membrane anchor domain has been suggested as one of many possible means of Alzheimer's prevention and treatment exploiting the alpha secretase pathway.
Two distinct modalities of alpha-secretase activity have been observed in cells; constitutive activity occurs mainly at the cell surface and is independent of regulatory mechanisms inside the cell, while regulated activity occurs mainly in the golgi and is dependent on the activity of protein kinase C. Alpha-secretase activity in the golgi is thought to compete directly with the beta-secretase pathway for APP substrates during membrane protein maturation.
Alfa-sekretaasilla on havaittu kaksi erilaista modulia Tuo hyvin nopea konstitutiivinen aktiivisuus tapahtuu pääasiassa solun pinnalla ja se on riippumaton säätelymekanismeista. joita on solun sisällä, kun taas säädelty aktiivisuus tapahtuu Golgin laitteessa ja se riippuu proteiinikinaasi C (PKC) aktiivisuudesta. Alfa-sekretaasitien aktiivisuuden Golgin laitteessa arvellaan kilpailevan suoraa beeta-sekretaasitien kanssa APP-substraatista kalvoproteiinin kyposymisen aikana.
(Huom. tässä on jokin solmukohtaasia. Jos APP määrä on suuri, niin silloin myös beetasekretaasi alkaa pilkkoa molekyyliä, mainitaan jossain. Nyt tulee mieleen MIKÄ säätää APP määrän? Onko APP määrän säätö suhteessa esim aivokuoren tahdonalaisuuteen, tahdonalaisten impulssien kehkeyttämiseen? Mikä korrelaatio on näissä asioissa? Missä cerebraalisissa kentissä APP tuottuu, missä enemmän, missä vähemmän? Miten sitä tuottuu lokomotion kentissä?)
Cell-surface cleavage by alpha secretase is very rapid after APP reaches the cell surface.
ALFA_SEKRETAASIN SUORITTAMA APP-molekyylin PILKKOMINEN ON HYVIN NOPEAA, HETI KUN MOLEKYYLI TULEE SOLUPINTAAN. Alfasekretaaseilla on funktiota oppimisen ja muistin muodostumisen säätelyssä. Tällä salfaAPP molekyylillä, jota samalla vapautuu on neorotroofista vaikutusta joka on antiapoptoottinen luonteeltaan ja edistää synapsin muodostusta. Tämä prosessi säätyy ylös jos ADAM10 on yliexpressiossa. Myös kehon ylin AC säätelijäpeptidi, signaalipeptidi PACAP pystyy säätämään alfasekretaasin aktiivisuutta ylöspäin.
The activity of alpha secretases has been implicated in the regulation of learning and memory formation. Release of the APPsα ectodomain has neurotrophic effects that counteract apoptotic signaling and promote synapse formation, processes that are upregulated when ADAM10 is overexpressed. Alpha secretase activity has also been observed to be upregulated in response to the signaling peptide PACAP.
Related alpha-secretases, including ADAM10, have also been implicated in similar maturation events for other transmembrane proteins such as MHC class I proteins. Recent evidence suggests that some such proteins are first processed to ectodomains by alpha secretases and subsequently cleaved by another Alzheimer's-associated protease complex, gamma secretase in its presenilin-complexed form.
Samankaltaiset alfasekretaasit ADAM 10 mukaanluettuna osallistuvat myös muitten transmembraanisten proteiinein kuten MHCI proteiinin kypsymistapahtumiin ( Major Histocompatibility Class I)
The Notch pathway bears many similarities to APP processing and is also regulated in part by ADAM10.

Inga kommentarer:
Skicka en kommentar