Katson ensin GLUTAMIININ kuljetuksesta olevaa tietoa. Sehän on aminohappo joka solussa toimii Glu-Gln-Asp-Asn aminohappojen fundamentaalissa syklissä sytoplasman ja mitokondrian kesken. Nämä neljä voivat muuttua toisikseen. Aspartaatti Asp fiksoi myös ammoniumia ja muuttuu asparagiiniksi Asn. Näistä sekä Glu että Asp ovat excitatorisia (stimuloivia) aminohappoja hermostossa, mutta eivät samassa kohdissa - ne eivät korvaa toisiansa. Ne ovat hienosäätöjärjestelmänä excitatorisissa reseptoreissa. On hyvä tietää jotain ruoasta ja ihmisen kehon proteiini ja energiatarpeesta, koska siten niitä tuoteita tulee aivojen autonomiselle alueella, missä aineenvaihduntakyky on hyvin kapea ja lopulta on vain muutama pieni mahdollisuus käsitellä ravinnon jätetuotteita. Ammoniumin käsittelyssä tämä aminohappojen minimaailman tapahtuma , ammoniumin fiksoiminen on sitten hyödynnetty aivokuoren energiaksi. Niin kauan kun maksa ja munuaiset ovat terveitä harva kiinnittää mitään huomiota proteiinin grammamäriin, mutta on tauteja, joissa proteiinin laatukin täytyy ottaa huomioon määrän lisäksi. Dietetiikassa annetan proteiinitarpeeksi johtolankana "Yksi gramma proteiinia painokiloa kohden päivässä", jotta kehon tarve katetaan. Mutta itse asiassa kehon proteiinikoneisto on niin valtava, että on vaikea tietää tarkallaan mikä on keholle parasta. Osanhan proteiineista keho valmistaa hiilihydraateista fiksoimalla niihin typpeä- sellainen aminohappo on glutamiinihappo. Kaikki tapahtumat mitä kehossa tapahtuu, tapahtuvat erilaisilla proteiinityövälineillä ja siten järjestelmää pidetään kunnossa korjaustyövälineillä, jotka nekin ovat proteiineja ja niillä on genomsia kaava joka tarvittaessa printataan esiin ja toteutetaan koodin antamasta kaavasta proteiiniksi. Osa niistä rakenneaminohapoista on sellaisia että keho pystyy kyhäämään niitä vaikka söisi vain karamellia , mutta jokaisessa proteiinissa on suuri osa sellaista aminohappoa mitä tulee ruoasta ja jota pystyy vain jokin kasvi syntetisoimaan. Oikotienä sitten voi käyttää animaalistakin proteiinia ruoassa saadakseen tarvitsemiaan alkuaineita kehoon. Muistin rakentuminen käyttää tätä glutamiinihappojärjestelmää, mutta ensisiaisesti sellaisina glutamiinihappoina jotka aivokudos itse endogeenisti kokoaa samalla vähentäen ammoniumia . Kuvssa näkyy lyhennys "alfaKG", alfaketoglutaarihappo ( elementaarin sitruunahappokierron TCA jäsen) . Se voi ottaa kaksi typpeä vastaan, muuttuu ensin glutamiinihapoksi ja sitten glutamiiniksi.
Suomennan joitain artikkelilauseita:
https://www.frontiersin.org/files/Articles/45768/fncel-07-00038-HTML/image_m/fncel-07-00038-g001.jpg
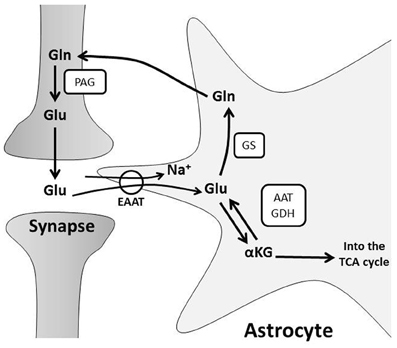
GLUTAMIINISYNTETAASI entsyymistä GS (Astroglian merkitsijä)
- Vuodelta 2007 löytyy artikkeli: NMDA reseptorit kontrolloivat aivojen glutamiinisynteesiä. NMDA-reseptorit ovat niitä joihin excitatorinen glutamiinihappo vaikuttaa stimuloivasti.
Front Biosci. 2007 Jan 1;12:883-90. Control of brain glutamine synthesis by NMDA receptors. Rodrigo R1, Felipo V.
Abstract
Glutamiinisyntetaasientsyymi GS osallistuu moneen tärkeään prosessiin aivoissa: se moduloi glutamaatin kiertoa GLU-GLN-syklissä, ammoniumin detoksikoimista ja joissain tilanteissa se moduloi aivoödemaa.
Tämä GS- entsyymin modulaatio aivoissa on tärkeä ja voi olla patologisia seuraamuksia , jos sGS- entsyymin systeemi on epäkunnossa tai kyllästettynä. Tässä katsauksessa tehdään yhteenvetoa siitä tiedosta, mitä glutamiinisyntetaasientsyymistä (GS) on, nim. että aivoissa sitä moduloi NMDA-reseptorit ja typpioksidi NO.
Jos in vivo kokeissa blokeerataan NMDA reseptorit, lisääntyy GS entsyymin aktiivisuus ja samalla glutamiinipitoisuus aivoissa nousee (GLN on paikallista aivoenergia-varaa). Tämä viittaa siihen, että NMDA-reseptorien ja typpioksidisyntetaasin (NOS) tooninen aktiivisuus pitää ylä toonista GS- inhibitiota.
Vain osa GS-inhibitiosta johtuu NMDA-reseptoreiden välittämästä NOS-aktivaatiosta (NO syntaasin aktivaatiosta) . Tässä kokeessa inhibitio johtui GS-entsyymin kovalentista modifikaatiosta, todennäköisesti tyrosiinien nitroitumisesta. Tämä modifikaatio saattaisi olla palautuva ja saattaisi olla olemassa GS-entsyymillä sitä denitrosyloiva tai denitroiva entsyymi ( joka vapauttaa typpioksidiyhdisteestä).
Lisäksi tutkijat havaitsivat, että GS-entsyymi ei toimi maksimaalinopeudella ja sen aktiivisuutta lisäisi NMDA-resptorien farmakologinen manipulaatio tai NO-pitoisuus. Tästä saattaisi olla hyötyä hyperammoniumemia tilanteessa aivojen ammoniapitoisuuden detoksikaatiossa ( Ammonia on aivolle myrkyllinen ja aiheuttaa enkefalopatiaa.Toimiva glutamiinihappo-glutamiini- järjestelmä pitää kurissa tätä ammoniumia ja solut saavat lisäksi glutamiinista aminoryhmän pilkkoutuessa vapautuvaa sidosenergiaa )
Tämä GS- entsyymin modulaatio aivoissa on tärkeä ja voi olla patologisia seuraamuksia , jos sGS- entsyymin systeemi on epäkunnossa tai kyllästettynä. Tässä katsauksessa tehdään yhteenvetoa siitä tiedosta, mitä glutamiinisyntetaasientsyymistä (GS) on, nim. että aivoissa sitä moduloi NMDA-reseptorit ja typpioksidi NO.
Jos in vivo kokeissa blokeerataan NMDA reseptorit, lisääntyy GS entsyymin aktiivisuus ja samalla glutamiinipitoisuus aivoissa nousee (GLN on paikallista aivoenergia-varaa). Tämä viittaa siihen, että NMDA-reseptorien ja typpioksidisyntetaasin (NOS) tooninen aktiivisuus pitää ylä toonista GS- inhibitiota.
Vain osa GS-inhibitiosta johtuu NMDA-reseptoreiden välittämästä NOS-aktivaatiosta (NO syntaasin aktivaatiosta) . Tässä kokeessa inhibitio johtui GS-entsyymin kovalentista modifikaatiosta, todennäköisesti tyrosiinien nitroitumisesta. Tämä modifikaatio saattaisi olla palautuva ja saattaisi olla olemassa GS-entsyymillä sitä denitrosyloiva tai denitroiva entsyymi ( joka vapauttaa typpioksidiyhdisteestä).
Lisäksi tutkijat havaitsivat, että GS-entsyymi ei toimi maksimaalinopeudella ja sen aktiivisuutta lisäisi NMDA-resptorien farmakologinen manipulaatio tai NO-pitoisuus. Tästä saattaisi olla hyötyä hyperammoniumemia tilanteessa aivojen ammoniapitoisuuden detoksikaatiossa ( Ammonia on aivolle myrkyllinen ja aiheuttaa enkefalopatiaa.Toimiva glutamiinihappo-glutamiini- järjestelmä pitää kurissa tätä ammoniumia ja solut saavat lisäksi glutamiinista aminoryhmän pilkkoutuessa vapautuvaa sidosenergiaa )
- Glutamine synthetase (GS) is involved in important processes in brain: modulation of the turnover of glutamate through the glutamate-glutamine cycle, detoxification of ammonia and, under certain circumstances, modulation of brain edema. Modulation of GS activity in brain is therefore important and its impairment or saturation may have pathological consequences. In this review we summarize the data showing that GS in brain is modulated by NMDA receptors and nitric oxide. Blocking NMDA receptors or nitric oxide synthase in vivo increases GS activity and glutamine content in brain, indicating that tonic activation of NMDA receptors and nitric oxide synthase maintain a tonic inhibition of GS. NMDA receptor-mediated activation of nitric oxide synthase is responsible only for part of the inhibition of GS. Other sources of nitric oxide also contribute to tonic inhibition.
- The inhibition is due to a covalent modification of GS, likely nitration of tyrosine residues. This modification would be reversible and it would be an enzyme that denitrosylate or denitrate GS. Moreover, GS would not be working at maximum rate and its activity may be increased pharmacologically by manipulating NMDA receptors or nitric oxide content. This may be useful for example to increase ammonia detoxification in brain in hyperammonemic situations.
GLUTAMIININ syntetisoiminen glutamiinihaposta
https://www.ncbi.nlm.nih.gov/pubmed/12020613
Neurochem Int. 2002 Aug-Sep;41(2-3):123-42.
GS entsyymi glutamiinisyntetaasa aivoissa sijaitsee pääasiallisesti ASTROSYYTEISSÄ. Astrosyyttien yksi päärooli on suojella neuronia sytotoksisuudelta ottamalla liika ammonium ja glutamaatti sisäänsä ja muutamalla glutamaatti neutraaliksi glutamiiniksi GS- entsyymillä ( glutamiinisyntetaasilla). Jos tämän GS- entsyymin ilmenemisessä tapahtuu muutoksia ne saattavat heijastaa ASTROGLIA-funktion muutoksia ja ne taas voivat vaikuttaa NEURONIEN funktioihin.
Hyperammoniumemia on tärkeä tekijä maksaperäisessä enkefalopatiassa ja se aiheuttaa ASTROGLIA-turvotusta. Tutkimuksissa on aiheutettu kokeellisesti hyperammoniumemiaa ja pitkäaikaistutkimuksissa on todettu ASTROGLIA-solujen pystyvän hyvin pitkälle adaptoitumaan ammoniumin korkeille pitoisuuksilla ja samalla glutamaatin korkeille pitoisuuksille.(Glutamaatti sinänsä on neurotoksinen, mutta tässä astrosyytti koettaa sen avulla saada pyydystettyä ammoniumia ja syntetisoi neutraalia glutamiinia enemmän)
Glutamine synthetase (GS) in brain is located mainly in astrocytes. One of the primary roles of astrocytes is to protect neurons against excitotoxicity by taking up excess ammonia and glutamate and converting it into glutamine via the enzyme GS. Changes in GS expression may reflect changes in astroglial function, which can affect neuronal functions. Hyperammonemia is an important factor responsible of hepatic encephalopathy (HE) and causes astroglial swelling. Hyperammonemia can be experimentally induced and an adaptive astroglial response to high levels of ammonia and glutamate seems to occur in long-term studies.
Hyperammoniumemiatiloissa ASTROGLIA-solut kokevat morfologisia muutoksia, jotka voivat muuntaa sen erilaisia funktioita kuten proteiinisynteesiä tai neurotransmittorien ottoa soluun. Yksi havaittu muutos on GS-entsyymin ilmenemän lisääntyminen niissä astrosyyteissä, joita on glutamaattiergisillä aivoalueilla. Glutamiinisyntetaasin ilmenemän indusoiminen näillä spesifisillä alueilla voisi tasapainottaa sitä liiallista ammoniumin ja glutamaatin ottoa ja suojella neurodegeneraatiolta, kun taas GS- ilmenemän väheneminen ei-glutamaattiergisillä aivoalueilla aiheuttaa rikkoutuman neuronin ja GLIA-solun välisissä metabolisissa interaktioissa hyperammoniumemian takia.
In hyperammonemic states, astroglial cells can experience morphological changes that may alter different astrocyte functions, such as protein synthesis or neurotransmitters uptake. One of the observed changes is the increase in the GS expression in astrocytes located in glutamatergic areas. The induction of GS expression in these specific areas would balance the increased ammonia and glutamate uptake and protect against neuronal degeneration, whereas, decrease of GS expression in non-glutamatergic areas could disrupt the neuron-glial metabolic interactions as a consequence of hyperammonemia.
Astrosyyteistä on kuvattu glutamiinisyntetaasin (GS) indusoituminen vasteena glutamaatille, joka vaikuttaa aktiivien glutamaattireseptorien kautta. Glutamaattireseptoreiden ylistimuloituminen voi myös suosia NO-modostusta NOS-aktivaation kautta ja useassa keskushermoston patogeneesissa onkin osoitettu taustalla NO-tekijä. Hyperammoniumemia saattaisi indusoida iNOS-muodostusta ASTROGLIA-soluissa ja siitä seuraisi NO-muodostusta, GS- entsyymin deaktivaatiota ja glutamaatin soluunoton alassäätymistä (mikä on neuronitoksista, koska synapsirakoon jäävä vapaa glutamaatti on toksinen tekijä- Neuronin sisälläkin oleva transmittoriglutamaatti on konsentroitu tarkasti rakkuloihin).
Induction of GS has been described in astrocytes in response to the action of glutamate on active glutamate receptors. The over-stimulation of glutamate receptors may also favour nitric oxide (NO) formation by activation of NO synthase (NOS), and NO has been implicated in the pathogenesis of several CNS diseases. Hyperammonemia could induce the formation of inducible NOS in astroglial cells, with the consequent NO formation, deactivation of GS and dawn-regulation of glutamate uptake.
Kuitenkin niillä aivoalueilla, joissa hermosto käyttää glutamaattiergistä excitaatiota sekä GLIA-solujen glutamaattireseptorit, GLIA-solujen glutamaatin (Glu,E) kuljettajat että GS glutamiinisyntetaasi entsyymi sijaitsevat paralleelisesti. Tämä viittaa siihen, että on olemassa funktionaalista kytköstä glutamaatin soluunoton, glutamaatinkuljettajan avulla glutamaatin degradaatioon johtamisen ja glutamiinin syntetaasin (GS) kesken, mikä vaimentaa näillä Glu-ergisillä alueilla aivon vaurioitumista. Hyperammoniumemiassa verisuonten välittömässä läheisyydessä sijaitsevat ASTROGLIA-solut glu-ergisillä alueilla näyttävät lisäävän GS-proteiinipitoisuuksia perivaskulaarisissa ulokkeissaan. Koska ammonium pääsee vapaasti BBB:n läpi ja astrosyytit taas ovat vastuussa BBB:n ylläpidosta, astrosyytin perivaskulaaristen ulokkeiden GS- entsyymi voisi tuottaa nopeasti neutraalia glutamiinia (Gln, Q) ja vapauttaa sitä vereen. Sellainen voisi estää korkean ammoniumpitoisuuden (NH3+) pääsemästä verestä aivojen puolelle ja siten vaimentaisi neurotoksisuutta. Nämä kriittisen GS- entsyymin sijoittumisen muutokset viittaavat siihen, että glutamaatti-glutamiini-sykli (glu-gln-sykli, EQ-sykli) saattaa olla toisin toimiva hyperammonemisissa tiloissa.
However, in glutamatergic areas, the distribution of both glial glutamate receptors and glial glutamate transporters parallels the GS location, suggesting a functional coupling between glutamate uptake and degradation by glutamate transporters and GS to attenuate brain injury in these areas. In hyperammonemia, the astroglial cells located in proximity to blood-vessels in glutamatergic areas show increased GS protein content in their perivascular processes. Since ammonia freely crosses the blood-brain barrier (BBB) and astrocytes are responsible for maintaining the BBB, the presence of GS in the perivascular processes could produce a rapid glutamine synthesis to be released into blood. It could, therefore, prevent the entry of high amounts of ammonia from circulation to attenuate neurotoxicity. The changes in the distribution of this critical enzyme suggests that the glutamate-glutamine cycle may be differentially impaired in hyperammonemic states.
Glutamine synthetase in brain: effect of ammonia
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4127817/
Front Chem. 2014; 2: 61.
Published online 2014 Aug 11. doi: 10.3389/fchem.2014.00061
PMCID: PMC4127817
Membrane transporters for the special amino acid glutamine: structure/function relationships and relevance to human heal
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5770653/
Front Oncol. 2017; 7: 306.
Published online 2017 Dec 11. doi: 10.3389/fonc.2017.00306
PMCID: PMC5770653
Glutamine Transport and Mitochondrial Metabolism in Cancer Cell Growth
GLUTAMAATTI
https://www.ncbi.nlm.nih.gov/pubmed/16516348
Neurochem Int. 2006 May-Jun;48(6-7):611-5. Epub 2006 Mar 3.
High-affinty glutamate transporter GLAST/EAAT1 regulates cell surface expression of glutamine/neutral amino acid transporter ASCT2 in human fetal astrocytes.
ASPARTAATTI

Inga kommentarer:
Skicka en kommentar