https://www.sciencedirect.com/science/article/pii/S0149763417306450
Katsaus artikkeli
Kortikostriaalisten ja hippokampisten neuronipiirien PDE inhibitio ja modulaatio. Kliininen katsaus ja translationaalinen pohdinta.
Review article
Phosphodiesterase
inhibition and modulation of corticostriatal and hippocampal circuits:
Clinical overview and translational considerations
Open Access funded by VSNU
Pääpiirteet, Higlights
Kortikostriaaliset ja hippokampiset johtumispiirit muodostavat neurobiologisen perustan monille neuropsykiatrisille häiriöille.
(Sivuhyppy:
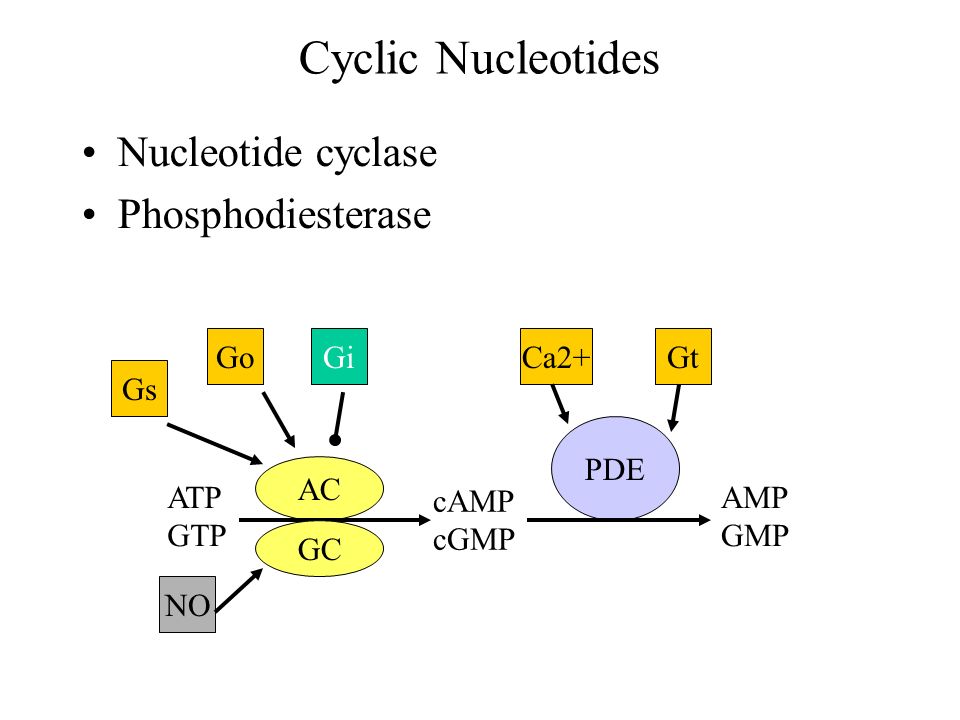
Kyseessä on entsyymiperhe PDE, fosfodiesteraasit. Mitä ne tekevät? Fosfodiesteraasi katkaisee syklisyyttä ylläpitävät fosfo-diesteri-sidokset, jolloin cAMP muuttuu tavalliseksi AMP:ksi.. Näitä PDE entyymeitä on paljon, mutta tässä artikkelissa keskitytään syklisten nukleotidimonofosfaattien (cNMP) metaboliseen pilkkoutumiseen muutamalla entsyymillä. Varsinkin tulehduksessa ja immuunisoluissa esim PDE4 on pääentsyymi metaboloimassa cAMP:tä .
Sen takia PDE4 -estäjät omaavat anti-inflammatorista vaikutusta, jopa antidepressiivistä ja antipsykoottista vaikutusta )
https://en.wikipedia.org/wiki/Phosphodiesterase
Tässä ensi kertaa katson näitä PDE- entsyymejä tarkemmin. Jos on väärinkäsityksiä- koetan oikaista sen mukaan kun käsitän yksityiskohtia.
Suomennosta artikkelsita:
Kortikostriaalisissa häiriöissä näyttäisi entsyymien PDE 1,4 ja 10 inhibiittorit kiinnostavilta, koska ne pystyvät moduloimaan dopamiiniergistä järjestelmää
Lupaavimpia inhibiittoreita hippokampisiin häiriötiloihin ovat PDE 3, 4 ja 9 estäjät.
PDE1, 4 and 10 inhibitors seem interesting for corticostriatal disorders due to their modulation of DAergic system.
- PDE3, 4 and 9 inhibitors are currently most promising for hippocampal disorders.
Toistaiseksi positiivisen prekliinisen tietomäärän paljous ei ole ollut translatoitavissa vakuuttavaksi kliiniseksi tehoksi.
Mahdollisesti paikallisesta cAMP ja cGMP nettomäärästä määräytyy solun ja funktion kohtalot.
- The local net amount of cAMP and/or cGMP will eventually determine the cellular and functional fate.

Näissä kuvissa näkyy periaatteellinen neuronaalinen piiri, josta on ollut tällainen käsitys jo pitkän aikaa, mutta yksityiskohtaisia energeettisiä tapahtumia selventyy vuosien varrella.
Varsinkin alue korteksin ja striatumin (neokorteksin ) välillä on ollut henkilökohtaisesti minulle sellainen vaikeasti tiedolla katettu kohta.
Nyt on fokuksessa PDE entsyymit, jotka voivat vaikuttaa korkeamman energian energiapakkauksista (NTP) peräisin olevien syklisten nukleotidimonofosfaattien (cNMP), sekundääristen signaalivälittäjien, pitoisuuteen rajoittavasti, koska ne poistavat syklisen muodon ja oikaisevat NMP:n. Kuvassa näytetään, missä kohtaa minkin tapainen PDE estää näiden signaalivälittäjien pysymistä, siis vaikutusaikaa. Niiden liian nopeasti purkaantumisesta voi seurata epätasapainoa ja viiveitä kortikostriaaliseen säätelyyn.
Katson edelleen kuvan selitystä:
Huom , noiden cAMP ja cGMP- syklisten monofosfaattien- tai anakin nukleotidimonofosfaattien muodostuminen ja säätely on kyllä vuosia sitten osattu asettaa karttaan dopaminergisten neuronien ja D- reseptoreiden suhteen, mutta minulle ainakin on uutta tai huomaamatta jäänyttä tuo fosfodiesteraasien (PDE) sijoittaminen tähän karttaan, joten otan siitä tarkemmin tässä, koska fosfodiesteraasien estäjistä ajatellaan terapeuttisia lääkkeitä. ja onhan ei -selektiivisiä PDE-estäjiä olemassa: Näitä "piristeitä" on käytetty ammoiset ajat: kaffeiini kahvissa, muut samanlaiset metyyliksantiinit; teofylliini.
Sitaatti otsikon artikkelsita:
Kortikostriataaliset neuronipiirit saavat alkunsa frontaaliaivokuoresta, etuaivojen harmaasta kuorikerroksesta ja ne kulkevat paateaivojen harmaiden tumakkeiden basaaliganglioiden kautta ja näistä taas lähtee projekteja releasemaan, talamukseen ja releestä palaa suoraa tietä rata etuaivoon, joten muodostuu yksisuuntainen neuronipiiriksi.
Striatumissa on omat neuronityypit MSN ( medium spiny neurons) , joista on projektiratoja edelleen ja niiden avulla välittyy sekä suora tie että epäsuoratie. Nämä striatumneuronit ovat kaikki GABA-neuroneita, paitsi vain eräästä tumakkeesta STN lähtee GLU- erginen stimulaatio GPi tumakkeeeseen, josta taas edelleen on GABA-ergistä virtaa talamusreleeseen. GABA moduloi thalamusrelettä, josta korteksiin menevä rata on glutaminierginen.
Corticostriatal circuits originate in the frontal cortex, pass through the basal ganglia, which project via the thalamus back to frontal brain areas. Output neurons in the striatum are medium spiny neurons
(MSNs), which consist of direct pathway and indirect pathway neurons.
The direct pathway neurons inhibit tonically active neurons in globus pallidus interna
(GPi)/substantia nigra pars reticulata (SNr). The indirect pathway
neurons activate neurons in GPi/SNr via inhibition of the globus
pallidus externa (GPe) and activation of the subthalamic nucleus (STN). Direct and indirect pathway neurons induce opposing effects on the output neurons in GPi/SNr, resulting in dis-inhibition and pro-inhibition of output, respectively. Within the basal ganglia all projections are GABAergic except those from the STN. Main phosphodiesterases (PDEs) expressed in corticostriatal circuits are PDE1B, PDE4 and PDE10A.
Fosfodiesteraasi 1B , PDE1B, yleesä asettuu samaan kuin D1 dopamiinireseptorit aivoissa ja sen katsotaan edustavan pääasiallista D1-reseptorien estomekanismia.
PDEB1- estäjät toimivat kuten dopamiiniagonistit, joten ne pystyvät lisäämään CREB- ja DARPP-32 fosforylaatiota ja täten edistämään synaptista välittymistä mm. AMPA reseptorilla , neuronin ärytyvyyttä ja synapto- ja neurogeneesiä, mikä johtaa neuronin plastisuuteen ja on protektiivista frontaalikortexin ja kortikostriaalisen neuronin glutamaattiergisessä synapsissa.
PDE4 fosfodiesteraasi estäessään cAMP /PKA signaloinnin säätelee kortikostriaalista signalointia ja linkkiytyy epäsuoran tien A2A-reseptorisignalointiin eikä sillä ole mitään suurempaa osaa D1-reseptorin suoran tien signaloinnissa.
Mutta vastakkainen tilanne on frontaalikortexin alueella. Siellä PDE4 on lokalisoitunut aivan kuten PDE1B eli DARPP-32- ilmentäviin neuroneihin.
Ja päinvastoin kuin striatumin alueella , frontaalikorteksissa PDE4 aiheuttaa lisää D1 reseptorin indusoimaa DARPP-32 fosforylaatiota, mikä viittaa PDE4:n huomattavaan rooliin frontaalisessa dopamiinireseptorisignaloinnissa.
Lopuksi- dopamiinin vapautuminen dopamiiniergisistä
keskiaivoterminaaleista voi vaikuttua PDE1- estäjistä, sillä SNc
neuroneissa ilmenee dopaminergisiä terminaaleja ja niissä on
osoitettu cAMP:n olevan tyrosiinihydroxylaasin (TH)
geenitranskriptionopeuden ja mRNA:n vahva indusoija - mitkä vaikuttavat
dopamiinin synteesiin ja vapautumiseen..
- Regulating corticostriatal signaling, the effect of PDE4 inhibition on cyclic adenosine monophosphate (cAMP)/protein kinase A (PKA) signaling is linked to indirect pathway adenosine A2a receptor signaling and has no major role in D1 receptor direct pathway signaling. An opposite situation is observed at frontal dopaminergic
signaling. In the frontal cortex PDE4 is –just as PDE1B- localized at
DARPP-32 expressing neurons. In contrast to the striatum, PDE4
inhibition enhances dopamine D1 receptor-induced phosphorylation of
DARPP-32 in the frontal cortex, indicating a prominent role of PDE4 in
frontal dopamine receptor signaling
Finally, dopamine release from
dopaminergic midbrain terminals can be influenced with a PDE4 inhibitor as dopamine is expressed at dopaminergic terminals in neurons of the substantia nigra pars compacta (SNc) in which cAMP has been reported to be a strong inducer of tyrosine hydroxylase gene transcription rate and mRNA affecting dopamine synthesis and release.
D1 reseptorisignalointiin liittyvän cAMP/PKA signaloinnin aktivoi
PDE10A inhibitio. mutta epäsuoran tien neuronien PDE10A inhibitio aktivoi cAMP/PKA signaloinnin samanaikaisesti vahvistamalla adenosiini A2A-reseptorisignalointia ja estämällä D2-reseptorin signaalin. Epäsuorassa tiessä dominoi PDE10A inhibitio, mutta PDE10A inhibitio ei lisää tyrosiinihydroxylaasin fosforyloitumista (päinvastoin kuin PDE4 inhibitio), joten sillä ei ole mitään vaikutuksia dopamiinin synteesiin tai vapautumiseen. Siitä huolimatta ei voida sulkea pois sitä että selektiiviset PDE estäjät saattaisivat vaikuttaa sekä suoraan että epäsuoraan tiehen lisäämällä dopamiinin vapautumista frontaalisista dopaminergisistä projektioista - riippuen vielä määrittämättä olevien PDE-entsyymien läsnäolosta näissä terminaaleissa.
- In
direct pathway neurons, PDE10A inhibition activates cAMP/PKA signaling
related to D1 receptor signaling whereas in indirect pathway neurons
PDE10A inhibition activates cAMP/PKA signaling by simultaneous
potentiation of adenosine A2A receptor signaling and inhibition of D2 receptor
signaling. Effects of PDE10A inhibition predominate the indirect
pathway. In contrast to PDE4 inhibition, PDE10A inhibition does not
increase tyrosine hydroxylase phosphorylation and therefore has no
effects on dopamine synthesis and release. Nevertheless, it cannot be
ruled out that selective PDE inhibitors
might influence both the direct and indirect pathway via enhancing the
release of dopamine from frontal dopaminergic projections depending on
the –to be determined- presence of PDEs in these terminals.
Striatumin interneuroneissa on NOS, typpioksidisyntaasia ja niissä tuottuu typpioksidia (NO) ja sitä diffundoituu striatumin MSN- neuronien dendriitteihin; niissä MSN- neuroneissa taas on korkea pitoisuus GC (GUCY) entsyymiä eli guanylaattisyklaasia, syklisen guanosiinimonofosfaatin cGMP-syntaasia. Jos striatumissa tapahtuu hetkellinen intrasellulaarinen cGMP-pitoisuuden nousu, niin - cAMP nousun jälkeen- se on pääasiallinen vaikuttaja neuronaalisen ärtyvyyden lisääntymisessä ja kortikostriaalisen glutamaattiergisen hermonvälittymisen nopeuttamisessa.
Täten selektiivisten PDE-alatyyppien estäjillä voidaan myös kohdentaa cGMP/proteiinikinaasi G(PKG) tiehen ja täten vaikuttaa kortikostriaaliseen funktioon.

Tässä on hippokampin puolelta PDE-funktiosta. tässä näkyy myös asetylkoliinireseptorit ja asetylkoliini.
Mitä vaikutusta PDE inhibitiolla on hippokampissa? Tässä on kaavaa pre- ja postsynaptisista soluprosesseista suhteutettuna sekundäärivälittäjäaineisiin cAMP ja cGMP, joilla on tärkeä merkityksensä muistin latautumisen LTP:hen liittyvän signaalin johtumisessa hippokampissa. Presynaptisesti sekä cAMP että cGMP-kaskadit voivat aiheuttaa lisääntynyttä neurotransmitterin ( hermosignaalinvälittäjäaineen) vapautumista. Postsynaptisesti molemmat kaskadit aktivoivat CREB- signaalitien , mikä johtaa lisääntyneeseen synaptiseen transmissioon, neuronin ärtyvyyteen, neuronin plastisuuteen ja on neuronia suojaavaa.
Fig. 4. Effects of PDE inhibition in the
hippocampal circuitry.
Schematic diagram of pre- and
postsynaptic cellular processes related to the
second messengers cAMP
and cGMP involved in LTP-related signal transduction in the
hippocampus. Presynaptically, both the cAMP and cGMP cascades can induce
enhanced
neurotransmitter release. Postsynaptically, both cascades activate the
CREB signaling pathway resulting in increased synaptic transmission, neuron excitability,
neuroplasticity and
neuroprotection.
Abbreviations:
PDE = phosphodiesterase;
Ca2+=calcium;
AC = adenylate cyclase;
ATP = adenosine triphosphate;
cAMP = cyclic adenosine monophosphate;
PKA = protein kinase A;
CREB = cAMP response element binding protein;
NMDA= N-methyl-D-aspartate;
nAChR = nicotinic acetylcholine receptors (α4β2 and α7);
mAChR = metabotropic acetylcholine receptor (M1, M3, M5).
Tähän asti jätän tänään PDE entsyymistä lukemisen. Pitää sulatella asiaa!
21.8.2018 14:55.



 Näissä kuvissa näkyy periaatteellinen neuronaalinen piiri, josta on ollut tällainen käsitys jo pitkän aikaa, mutta yksityiskohtaisia energeettisiä tapahtumia selventyy vuosien varrella.
Näissä kuvissa näkyy periaatteellinen neuronaalinen piiri, josta on ollut tällainen käsitys jo pitkän aikaa, mutta yksityiskohtaisia energeettisiä tapahtumia selventyy vuosien varrella. Tässä on hippokampin puolelta PDE-funktiosta. tässä näkyy myös asetylkoliinireseptorit ja asetylkoliini.
Tässä on hippokampin puolelta PDE-funktiosta. tässä näkyy myös asetylkoliinireseptorit ja asetylkoliini.