https://www.ncbi.nlm.nih.gov/pubmed/30087260
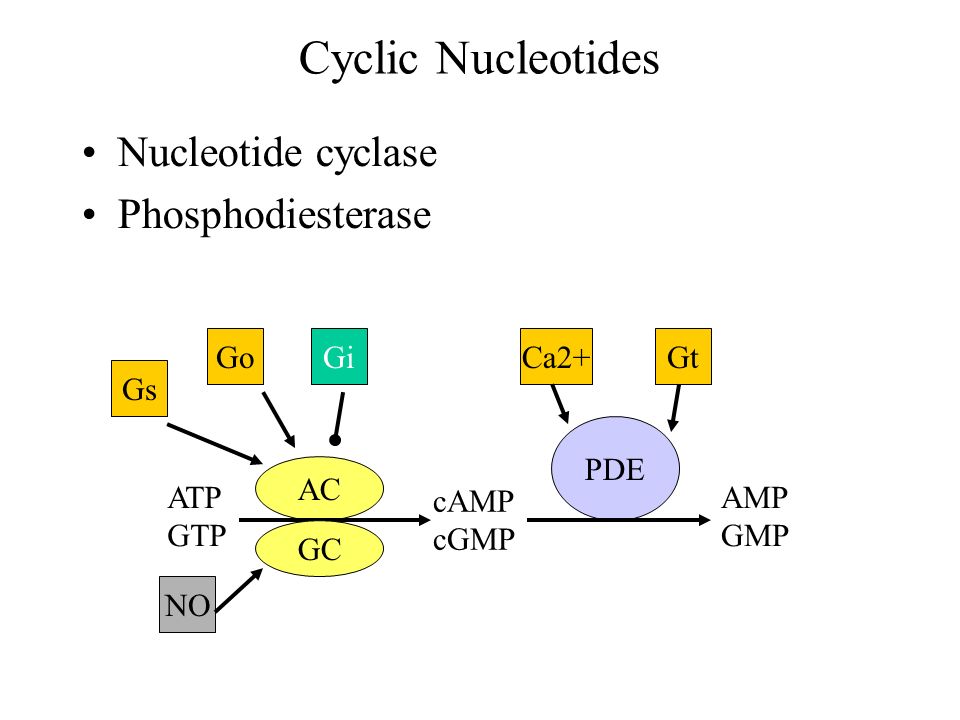
Suom. Huonontunut NO-cGMP-signalointi on liittynyt useisiin neurologisiin tauteihin. NO-sensitiiviset guanylyylisyklaasit (NO-GC) , joista kaksi isoformia tunnetaan, edustavat lupaava lääkekohdetta aivojen cGMP-pitoisuuden kohottamiseksi.
On jo löydetty joitain pieniä lääkkeen kaltaisia molekyylejä, jotka vaikuttavat synergistisesti NO:n kanssa stimuloiden NO-GC entsyymiaktiivisututa. Kuitenkaan näiden stimulaatorien aivovaikutuksia ei vielä oiken ymmärretä ja tämä artikkeli kertoo yksityiskohtaisista tutkimuksista hiirellä ja johtopäätös on: On tullut selväksi jo, että NO-GC- entsyymistimulaattorit voivat lisätä
cGMP-signalointia neuronissa ja niitä pitäisi kehittää edelleen
neurologisten tautien hoitoon.
Int J Mol Sci. 2018 Aug 7;19(8). pii: E2313. doi: 10.3390/ijms19082313.
cGMP
Imaging in Brain Slices Reveals Brain Region-Specific Activity of
NO-Sensitive Guanylyl Cyclases (NO-GCs) and NO-GC Stimulators.
Abstract
Impaired
NO-cGMP signaling has been linked to several neurological disorders.
NO-sensitive guanylyl cyclase (NO-GC), of which two isoforms-NO-GC1
and NO-GC2-are known, represents a promising drug target to increase
cGMP in the brain. Drug-like small molecules have been discovered that
work synergistically with NO to stimulate NO-GC activity. However, the
effects of NO-GC stimulators in the brain are not well understood.
In
the present study, we used Förster/fluorescence resonance energy
transfer (FRET)-based real-time imaging of cGMP in acute brain slices
and primary neurons of cGMP sensor mice to comparatively assess the
activity of two structurally different NO-GC stimulators, IWP-051 and
BAY 41-2272, in the cerebellum, striatum and hippocampus. BAY 41-2272
potentiated an elevation of cGMP induced by the NO donor DEA/NO in all
tested brain regions. Interestingly, IWP-051 potentiated DEA/NO-induced
cGMP increases in the cerebellum and striatum, but not in the
hippocampal CA1 area or primary hippocampal neurons. The
brain-region-selective activity of IWP-051 suggested that it might act
in a NO-GC isoform-selective manner.
Results of mRNA in situ
hybridization indicated that the cerebellum and striatum express NO-GC1
and NO-GC2, while the hippocampal CA1 area expresses mainly NO-GC2.
IWP-051-potentiated DEA/NO-induced cGMP signals in the striatum of
NO-GC2 knockout mice but was ineffective in the striatum of NO-GC1 knockout mice. These results indicate that IWP-051 preferentially stimulates NO-GC1
signaling in brain slices.
Interestingly, no evidence for an
isoform-specific effect of IWP-051 was observed when the cGMP-forming
activity of whole brain homogenates was measured. This apparent
discrepancy suggests that the method and conditions of cGMP measurement
can influence results with NO-GC stimulators. Nevertheless, it is clear
that NO-GC stimulators enhance cGMP signaling in the brain and should be
further developed for the treatment of neurological diseases.
KEYWORDS:
Cyclic
GMP; FRET imaging; NO-GC stimulators; Purkinje cells; cerebellar
granule cells; guanylyl cyclase; hippocampal neurons; nitric oxide;
striatum; transgenic mice